[단독]큐리언트가 기술수출한 ‘텔라세벡’, 부룰리궤양 임상서 환자 전원 완치 확인
등록 2025-10-23 오전 5:00:00
팜이데일리 프리미엄 기사를 무단 전재·유포하는 행위는 불법이며 형사 처벌 대상입니다.
이에 대해 팜이데일리는 무관용 원칙을 적용해 강력히 대응합니다.
이에 대해 팜이데일리는 무관용 원칙을 적용해 강력히 대응합니다.
이 기사는 2025년10월23일 5시0분에 팜이데일리 프리미엄 콘텐츠로 선공개 되었습니다.
구독하기
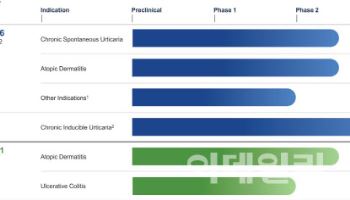
[이데일리 나은경 기자] 큐리언트(115180)가 개발한 부룰리궤양 치료제 후보물질 ‘텔라세벡’ 투약 환자 40명 전원이 임상 2a상에서 완치 판정을 받았다. 텔라세벡은 국제 결핵치료제 개발기구 TB얼라이언스에 기술수출돼 현재 TB얼라이언스가 개발전권을 갖고 있다. TB얼라이언스는 임상 2b상 종료 후 조건부 허가 신청을 제출할 예정인데, 허가시 원개발사인 큐리언트가 수령하게 될 우선심사 바우처(PRV)에 관심이 모인다.
22일 오전(현지시간) 미국 조지아주 애틀랜타에서 개최 중인 IDWeek 2025에서 발표된 내용에 따르면 부룰리궤양 성인 환자 40명에게 300㎎의 텔라세벡(Q203)을 4주간 매일 단독 투약한 결과 100%의 환자에서 병변이 완전히 회복된 것을 확인했다.
이 임상시험은 호주에서 진행된 것으로, TB얼라이언스는 지난 7월부터 환자 80명을 추가 모집해 동일 방식의 확장임상인 임상 2b상을 진행 중이다. 확장임상에서도 100% 완치가 확인되면 텔라세벡의 조건부 허가를 노려볼 수 있다.
앞서 세계보건기구(WHO)가 주관한 피부 관련 열대소외질환 국제회의에서 TB얼라이언스가 발표한 임상 2a상 중간결과에서도 긍정적인 데이터가 도출돼 임상 2a상 최종 데이터에 대한 관심이 높았다. 당시 TB얼라이언스는 84%의 환자에서 병변이 완전히 회복됐고 나머지 환자들은 재상피화가 진행되고 있다고 밝힌 바 있다. 해당 데이터는 40명에게 4주간 텔라세벡을 투약하고 투약 29일째 환부에서 채취한 검체를 12주간 배양한 결과였고, 이번에 발표된 데이터는 해당 환자들의 검체를 52주간 배양한 결과다.
동물실험에서 완치를 확인한 데 이어 환자 40명 대상의 임상 2a상에서도 완치가 확인됐으므로, 진행 중인 80명 대상의 임상 2b상에 대해서도 완치 가능성은 높게 평가된다. TB얼라이언스는 또 임상 2a상 환자 중 중도탈락한 환자는 없으며 심각한 이상반응없이 경미한 수준의 이상반응만이 관찰됐다고도 했다.
텔라세벡은 균 에너지 대사에 관여하는 사이토크롬bc1 복합체를 억제하는 기전으로, 한국파스퇴르연구소에서 개발하던 것을 큐리언트가 기술도입했다. 현재 텔라세벡은 부룰리궤양은 물론 결핵, 한센병 치료제로도 개발되고 있으며, TB얼라이언스는 이중 가장 임상 기간이 짧은 부룰리궤양으로 먼저 임상시험을 진행하고 있다.
부룰리궤양은 마이코박테리움 울세란스균이 피부 속 세포와 모세혈관, 피하지방을 파괴해 일어나는 피부괴사 질환이다. 아프리카, 호주, 남미 등에서 주로 발생되는 열대질환이기도 하다. 주로 팔, 다리에 감염되는데 제때 치료하지 않으면 팔, 다리를 절단해야 할 수 있고 심하면 사망에 이르기도 한다.
난치성 질환이라 치료가 진행될수록 통증은 심해지는데 지금까지 개발된 치료제로는 완치까지 약 6개월간 꾸준한 항생제 투약이 요구돼 미충족 수요가 높다. 이 같은 상황에서 텔라세벡은 치료기간을 줄이고 항생제 복합처방 외 선택지가 될 수 있다는 점에서 가치가 있다.
지난 2023년 2월 큐리언트는 국제 결핵치료제 개발기구 TB얼라이언스에 한국과 러시아 및 독립국가연합(CIS) 지역을 제외한 텔라세벡의 개발 및 상업화 글로벌 독점권리를 기술수출했다. 비영리 국제기구인 TB얼라이언스에 기술수출을 한 만큼 큐리언트는 기술수출 당시 선급금을 받지는 못했다. 하지만 계약 당시 PRV(Priority Review Voucher) 수취권은 큐리언트의 것으로 남았다.
PRV란 1년 이상 걸리는 신약승인 검토 기간을 6개월로 줄일 수 있는 권리로, 제약사들로 하여금 열대 소외질환 등 중저소득국에서 발병률이 높은 질병의 치료제 개발을 독려하기 위해 미국 식품의약국(FDA)이 제공하는 인센티브 제도다.
열대 소외질환으로 최소 조건부 허가를 받아야 PRV를 수령할 수 있다. PRV는 일종의 바우처로, 이를 수령하면 제3자에 매매 방식으로 양도해 현금화할 수 있다. PRV는 현재 1억6000만 달러(약 2300억원) 수준에서 거래되고 있다.
22일 오전(현지시간) 미국 조지아주 애틀랜타에서 개최 중인 IDWeek 2025에서 발표된 내용에 따르면 부룰리궤양 성인 환자 40명에게 300㎎의 텔라세벡(Q203)을 4주간 매일 단독 투약한 결과 100%의 환자에서 병변이 완전히 회복된 것을 확인했다.
|
이 임상시험은 호주에서 진행된 것으로, TB얼라이언스는 지난 7월부터 환자 80명을 추가 모집해 동일 방식의 확장임상인 임상 2b상을 진행 중이다. 확장임상에서도 100% 완치가 확인되면 텔라세벡의 조건부 허가를 노려볼 수 있다.
앞서 세계보건기구(WHO)가 주관한 피부 관련 열대소외질환 국제회의에서 TB얼라이언스가 발표한 임상 2a상 중간결과에서도 긍정적인 데이터가 도출돼 임상 2a상 최종 데이터에 대한 관심이 높았다. 당시 TB얼라이언스는 84%의 환자에서 병변이 완전히 회복됐고 나머지 환자들은 재상피화가 진행되고 있다고 밝힌 바 있다. 해당 데이터는 40명에게 4주간 텔라세벡을 투약하고 투약 29일째 환부에서 채취한 검체를 12주간 배양한 결과였고, 이번에 발표된 데이터는 해당 환자들의 검체를 52주간 배양한 결과다.
동물실험에서 완치를 확인한 데 이어 환자 40명 대상의 임상 2a상에서도 완치가 확인됐으므로, 진행 중인 80명 대상의 임상 2b상에 대해서도 완치 가능성은 높게 평가된다. TB얼라이언스는 또 임상 2a상 환자 중 중도탈락한 환자는 없으며 심각한 이상반응없이 경미한 수준의 이상반응만이 관찰됐다고도 했다.
텔라세벡은 균 에너지 대사에 관여하는 사이토크롬bc1 복합체를 억제하는 기전으로, 한국파스퇴르연구소에서 개발하던 것을 큐리언트가 기술도입했다. 현재 텔라세벡은 부룰리궤양은 물론 결핵, 한센병 치료제로도 개발되고 있으며, TB얼라이언스는 이중 가장 임상 기간이 짧은 부룰리궤양으로 먼저 임상시험을 진행하고 있다.
부룰리궤양은 마이코박테리움 울세란스균이 피부 속 세포와 모세혈관, 피하지방을 파괴해 일어나는 피부괴사 질환이다. 아프리카, 호주, 남미 등에서 주로 발생되는 열대질환이기도 하다. 주로 팔, 다리에 감염되는데 제때 치료하지 않으면 팔, 다리를 절단해야 할 수 있고 심하면 사망에 이르기도 한다.
난치성 질환이라 치료가 진행될수록 통증은 심해지는데 지금까지 개발된 치료제로는 완치까지 약 6개월간 꾸준한 항생제 투약이 요구돼 미충족 수요가 높다. 이 같은 상황에서 텔라세벡은 치료기간을 줄이고 항생제 복합처방 외 선택지가 될 수 있다는 점에서 가치가 있다.
지난 2023년 2월 큐리언트는 국제 결핵치료제 개발기구 TB얼라이언스에 한국과 러시아 및 독립국가연합(CIS) 지역을 제외한 텔라세벡의 개발 및 상업화 글로벌 독점권리를 기술수출했다. 비영리 국제기구인 TB얼라이언스에 기술수출을 한 만큼 큐리언트는 기술수출 당시 선급금을 받지는 못했다. 하지만 계약 당시 PRV(Priority Review Voucher) 수취권은 큐리언트의 것으로 남았다.
PRV란 1년 이상 걸리는 신약승인 검토 기간을 6개월로 줄일 수 있는 권리로, 제약사들로 하여금 열대 소외질환 등 중저소득국에서 발병률이 높은 질병의 치료제 개발을 독려하기 위해 미국 식품의약국(FDA)이 제공하는 인센티브 제도다.
열대 소외질환으로 최소 조건부 허가를 받아야 PRV를 수령할 수 있다. PRV는 일종의 바우처로, 이를 수령하면 제3자에 매매 방식으로 양도해 현금화할 수 있다. PRV는 현재 1억6000만 달러(약 2300억원) 수준에서 거래되고 있다.

나은경 eeee@






![로킷헬스케어, 한달 새 두배 이상 주가 ↑...Sk케미칼도 급등[바이오맥짚기]](https://image.edaily.co.kr/images/vision/files/NP/S/2025/10/PS25102300216b.jpg)