HLB, CRL 2번 수령해도 中 항서제약 품을 수밖에 없는 이유
등록 2025-03-26 오전 9:05:31
- 지난해 5월 이어 이번에도 항서제약 CMC 문제가 ‘발목’
리보세라닙 특허 이슈 때문에 항서제약과 협업 필수적
팜이데일리 프리미엄 기사를 무단 전재·유포하는 행위는 불법이며 형사 처벌 대상입니다.
이에 대해 팜이데일리는 무관용 원칙을 적용해 강력히 대응합니다.
이에 대해 팜이데일리는 무관용 원칙을 적용해 강력히 대응합니다.
이 기사는 2025년3월26일 9시5분에 팜이데일리 프리미엄 콘텐츠로 선공개 되었습니다.
구독하기
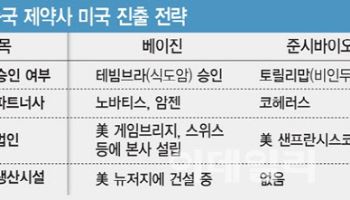
[이데일리 김새미 기자] HLB(028300)가 지난해 5월에 이어 이번에도 파트너사인 중국 항서제약의 화학·제조·품질관리(CMC) 문제에 발목을 잡혔지만 양사 파트너십은 견고할 전망이다. HLB의 표적항암제 ‘리보세라닙’과 항서제약의 면역항암제 ‘캄렐리주맙’은 떼려야 뗄 수 없는 사이이기 때문이다. HLB가 리보세라닙 약효에 문제가 없다면서도 단독요법이 아닌 캄렐리주맙과 병용요법으로 신약허가신청(NDA)를 고수하는 이유 중 하나는 특허 문제가 얽혀있기 때문으로 확인됐다.
CMC 문제가 또 발목…조속한 해결 가능할까?
앞서 HLB는 지난 21일 FDA로부터 2차 보완요구서한(CRL)을 수령했다고 밝혔다. 진양곤 HLB그룹 회장은 “이번 CRL 사유는 항서제약의 CMC 지적사항이 충분히 해소되지 않았다는 이유”라고 알렸다. 이어 “1차에서는 캄렐리주맙의 CMC와 임상기관 실사(BIMO) 두 분야에서 10개의 지적사항으로 광범위하고 개수가 많았지만 2차에서는 지적사항이 딱 3개고, 정확하게 입증할 수 있는 내용들로 구성됐다”면서 빠르게 해결 가능할 것으로 봤다.
일각에선 경미한 사안이라면서도 CMC 문제로 재차 발목이 잡히면서 해당 이슈가 신속하게 해결 가능한 것인가에 대한 의구심이 제기되고 있다. CMC는 신약 성분의 화학적 특성과 함께 제조 공정의 전반을 평가하는 항목으로 미국 식품의약국(FDA)에서 깐깐하게 점검하는 항목이다. 최근 FDA는 심사관이 의약품 생산시설에 방문해 전체 생산시설과 공정을 직접 확인하는 CMC 실사를 늘리고 있는 추세다.
바이오업계 관계자는 “FDA가 진짜 경미한 사안이라면 사유를 구체적으로 적시해주는 걸로 알고 있다”면서 “FDA가 CRL에 구체적인 이유를 적지 않았다고 하는 걸 봐선 생각보다 심각한 사안일 수도 있다”고 우려했다.
더구나 HLB의 공시에 따르면 FDA는 CRL을 통해 “리보세라닙의 안전성과 효능은 캄렐리주맙(SHR-1210)과만 결합해서 입증됐기 때문에 캄렐리주맙에 대한 규제 승인 조치가 발표될 때까지 리보세라닙을 승인하지 않을 것(Because the safety and effectiveness of Tulvegio(rivoceranib) has only been established in combination with SHR-1210, we will not approve rivoceranib until a regulatory approval action is issued for SHR-1210.)”이라고 통보했다. 즉 캄렐리주맙이 FDA의 승인을 받아야 리보세라닙도 병용요법으로 신약허가를 받을 수 있다는 얘기다.
단독요법 아닌 캄렐리주맙 병용요법 고수하는 이유?
이 때문에 리보세라닙+캄렐리주맙 병용요법에 대한 신약허가를 받기까지 상당한 시일이 걸릴 수 있다는 관측도 나온다. 일각에선 리보세라닙 단독요법으로 FDA의 신약허가를 받는 게 빠른 것 아니냐는 얘기도 나온다. 그럼에도 HLB가 캄렐리주맙과 병용요법으로 NDA를 고수하는 데에는 리보세라닙 특허 문제와 관련 있는 것으로 파악됐다. 리보세라닙의 물질특허는 사실상 거의 만료됐으며, 항서제약이 글로벌 권리를 보유하고 있는 염 특허도 소멸 위기에 처해있다.
물질 특허란 신약의 가장 기본적인 활성 성분, 신규 화합물에 대한 특허로 통상 출원일로부터 20년 정도 유효하다. 리보세라닙은 중국계 미국인 폴 첸 박사가 2004년 물질특허를 획득했다. 염 특허는 원래의 약물 화합물에 염 형태를 결합해 물리적 특성을 개선한 형태에 관한 특허로, 물질 특허 만료가 다가올 때 보호 기간을 연장하기 위해 흔히 활용되는 특허이다.
리보세라닙의 물질특허는 중국 내 특허 만료 기간이 2022년으로 만료됐다. 이에 따라 중국 항서제약으로부터 로열티를 수령하는 것도 2022년 종결됐다. 중국 외 지역의 경우 국가별 연장 제도에 따라 최대 2029년까지 연장이 가능하다.
리보세라닙의 염 특허는 중국에선 2028년, 미국에선 2029년 만료된다. 리보세라닙의 염 특허는 중국을 포함한 글로벌 권리를 항서제약이 보유하고 있기 때문에 해당 특허 연장을 위해선 항서제약과 협조가 필수적인 상황이다. 중국 외 지역은 최대 2034년까지 특허를 연장할 수 있지만 중국 내 염 특허는 소송 결과에 따라 소멸될 수도 있다. 현재 항서제약은 중국의 한 업체와 염 특허 관련 소송을 진행 중이다. 해당 소송에서 승소할 경우 중국 내 염 특허가 2028년까지 보장되지만 패소할 경우 중국 내 2022년 이후 특허 보존이 불가해 염 특허가 소멸된다.
진 회장은 지난 21일 기자간담회에서 “리보세라닙의 특허 만료는 사실상 2034년이라 약간 경제성이 떨어지기 때문”이라고 언급한 바 있다. 이는 해당 특허 만료 기간은 중국 외 지역 염 특허를 최대 2034년까지 연장할 수 있다는 점을 염두에 두고 발언한 셈이다. 리보세라닙의 물질 특허는 중국 외 지역의 경우 최대 2029년까지만 연장되기 때문에 상용화하더라도 시장성이 떨어진다.
이 때문에 HLB는 캄렐리주맙과 병용해 2038년까지 특허 기간을 늘리려는 전략을 택한 것으로 보인다. 캄렐리주맙의 물질특허는 단독요법 기준으로는 2035년까지 인정받으며, 병용요법으로는 2038년까지 존속된다.
시장 규모와 병용데이터도 고려
HLB가 2019년 위암 3차치료제로 글로벌 임상 3상을 마쳤는데도 단독요법이 아닌 간암치료제로 병용요법에 도전하기로 임상개발 전략을 바꾼 데에는 시장 상황의 변화 영향도 컸다. 위암 3차 치료제 시장에 비해 간암 1차 치료제 시장의 규모가 훨씬 크다는 점도 크게 작용했다.
위암 3차 치료제는 1·2차 치료제가 모두 실패했거나 더 이상 효과가 없을 때 투여하기 때문에 시장 규모가 작을 수밖에 없다. 지난해 글로벌 위암치료제 시장 규모는 47억달러(약 6조8880억원)에서 60억8000만달러(약 8조9100억원) 사이로 추산되지만 이 중 위암 3차 치료제 시장 규모는 상당히 작을 것으로 추정된다. 반면 글로벌 시장조사기관 글로벌 마켓 인사이트(Global Market Insights)에 따르면 글로벌 간암 치료제 시장은 2023년 29억달러(약 4조2520억원)로 아직 위암 치료제 시장보다 규모가 작지만 2032년에는 76억달러(약 11억1430억원)로 성장할 것으로 전망된다.
HLB 관계자는 “간암 1차 치료제의 경우 파트너사인 항서제약이 중국에서 이미 임상 2상을 끝내 좋은 결과를 얻은 적응증으로, 시장 규모가 매우 크고 당시 소라페닙, 렌바티닙 등 2개의 약물만 허가받아 시장을 양분하고 있었다”라며 “리보세라닙의 약효가 없어서 위암 3차 치료제 임상을 이어가지 않은 것이 아니다”라고 설명했다.
리보세라닙 단독요법보다 캄렐리주맙과 병용 시 더 좋은 약효가 확인된 것도 항서제약과 협업에 힘을 싣는 요인이었다. HLB 관계자는 “캄렐리주맙과 병용 시 더 좋은 약효가 확인됐기 때문에 간암 1차 치료제로 리보세라닙+캄렐리주맙 병용요법을 진행 시 기존 치료제 대비 확실한 우위를 점할 수 있을 것으로 판단했다”며 “제한된 자원에서 성공 확률과 시장성을 높이기 위한 전략적 판단으로 결정한 것”이라고 강조했다.
결과적으로 HLB와 항서제약은 한 배를 탄 처지지만 키는 항서제약이 쥐고 있는 것으로 보인다. 캄렐리주맙이 FDA의 관문을 넘어야 리보세라닙도 병용요법으로 신약허가를 받고 북미 시장에 진출할 수 있기 때문이다. 항서제약이 중국 제약사라는 점이 걸림돌로 작용할 것이라는 우려도 여전하다.
업계 관계자는 “CMC 보완 요구를 해결하더라도 생산시설 실사를 또 나올 수도 있고 이 경우 HLB 생각보다 시간이 더 걸릴 수도 있다”면서 “이것만 해결되면 신약 승인을 받을 수 있을지도 확실치는 않다. FDA가 과학적으로 판단하는 기업이라 해도 생물보안법 등 정치적 영향을 아예 배제하긴 어려울 수도 있다”고 언급했다.
CMC 문제가 또 발목…조속한 해결 가능할까?
앞서 HLB는 지난 21일 FDA로부터 2차 보완요구서한(CRL)을 수령했다고 밝혔다. 진양곤 HLB그룹 회장은 “이번 CRL 사유는 항서제약의 CMC 지적사항이 충분히 해소되지 않았다는 이유”라고 알렸다. 이어 “1차에서는 캄렐리주맙의 CMC와 임상기관 실사(BIMO) 두 분야에서 10개의 지적사항으로 광범위하고 개수가 많았지만 2차에서는 지적사항이 딱 3개고, 정확하게 입증할 수 있는 내용들로 구성됐다”면서 빠르게 해결 가능할 것으로 봤다.
|
바이오업계 관계자는 “FDA가 진짜 경미한 사안이라면 사유를 구체적으로 적시해주는 걸로 알고 있다”면서 “FDA가 CRL에 구체적인 이유를 적지 않았다고 하는 걸 봐선 생각보다 심각한 사안일 수도 있다”고 우려했다.
더구나 HLB의 공시에 따르면 FDA는 CRL을 통해 “리보세라닙의 안전성과 효능은 캄렐리주맙(SHR-1210)과만 결합해서 입증됐기 때문에 캄렐리주맙에 대한 규제 승인 조치가 발표될 때까지 리보세라닙을 승인하지 않을 것(Because the safety and effectiveness of Tulvegio(rivoceranib) has only been established in combination with SHR-1210, we will not approve rivoceranib until a regulatory approval action is issued for SHR-1210.)”이라고 통보했다. 즉 캄렐리주맙이 FDA의 승인을 받아야 리보세라닙도 병용요법으로 신약허가를 받을 수 있다는 얘기다.
단독요법 아닌 캄렐리주맙 병용요법 고수하는 이유?
이 때문에 리보세라닙+캄렐리주맙 병용요법에 대한 신약허가를 받기까지 상당한 시일이 걸릴 수 있다는 관측도 나온다. 일각에선 리보세라닙 단독요법으로 FDA의 신약허가를 받는 게 빠른 것 아니냐는 얘기도 나온다. 그럼에도 HLB가 캄렐리주맙과 병용요법으로 NDA를 고수하는 데에는 리보세라닙 특허 문제와 관련 있는 것으로 파악됐다. 리보세라닙의 물질특허는 사실상 거의 만료됐으며, 항서제약이 글로벌 권리를 보유하고 있는 염 특허도 소멸 위기에 처해있다.
물질 특허란 신약의 가장 기본적인 활성 성분, 신규 화합물에 대한 특허로 통상 출원일로부터 20년 정도 유효하다. 리보세라닙은 중국계 미국인 폴 첸 박사가 2004년 물질특허를 획득했다. 염 특허는 원래의 약물 화합물에 염 형태를 결합해 물리적 특성을 개선한 형태에 관한 특허로, 물질 특허 만료가 다가올 때 보호 기간을 연장하기 위해 흔히 활용되는 특허이다.
리보세라닙의 물질특허는 중국 내 특허 만료 기간이 2022년으로 만료됐다. 이에 따라 중국 항서제약으로부터 로열티를 수령하는 것도 2022년 종결됐다. 중국 외 지역의 경우 국가별 연장 제도에 따라 최대 2029년까지 연장이 가능하다.
리보세라닙의 염 특허는 중국에선 2028년, 미국에선 2029년 만료된다. 리보세라닙의 염 특허는 중국을 포함한 글로벌 권리를 항서제약이 보유하고 있기 때문에 해당 특허 연장을 위해선 항서제약과 협조가 필수적인 상황이다. 중국 외 지역은 최대 2034년까지 특허를 연장할 수 있지만 중국 내 염 특허는 소송 결과에 따라 소멸될 수도 있다. 현재 항서제약은 중국의 한 업체와 염 특허 관련 소송을 진행 중이다. 해당 소송에서 승소할 경우 중국 내 염 특허가 2028년까지 보장되지만 패소할 경우 중국 내 2022년 이후 특허 보존이 불가해 염 특허가 소멸된다.
진 회장은 지난 21일 기자간담회에서 “리보세라닙의 특허 만료는 사실상 2034년이라 약간 경제성이 떨어지기 때문”이라고 언급한 바 있다. 이는 해당 특허 만료 기간은 중국 외 지역 염 특허를 최대 2034년까지 연장할 수 있다는 점을 염두에 두고 발언한 셈이다. 리보세라닙의 물질 특허는 중국 외 지역의 경우 최대 2029년까지만 연장되기 때문에 상용화하더라도 시장성이 떨어진다.
이 때문에 HLB는 캄렐리주맙과 병용해 2038년까지 특허 기간을 늘리려는 전략을 택한 것으로 보인다. 캄렐리주맙의 물질특허는 단독요법 기준으로는 2035년까지 인정받으며, 병용요법으로는 2038년까지 존속된다.
시장 규모와 병용데이터도 고려
HLB가 2019년 위암 3차치료제로 글로벌 임상 3상을 마쳤는데도 단독요법이 아닌 간암치료제로 병용요법에 도전하기로 임상개발 전략을 바꾼 데에는 시장 상황의 변화 영향도 컸다. 위암 3차 치료제 시장에 비해 간암 1차 치료제 시장의 규모가 훨씬 크다는 점도 크게 작용했다.
위암 3차 치료제는 1·2차 치료제가 모두 실패했거나 더 이상 효과가 없을 때 투여하기 때문에 시장 규모가 작을 수밖에 없다. 지난해 글로벌 위암치료제 시장 규모는 47억달러(약 6조8880억원)에서 60억8000만달러(약 8조9100억원) 사이로 추산되지만 이 중 위암 3차 치료제 시장 규모는 상당히 작을 것으로 추정된다. 반면 글로벌 시장조사기관 글로벌 마켓 인사이트(Global Market Insights)에 따르면 글로벌 간암 치료제 시장은 2023년 29억달러(약 4조2520억원)로 아직 위암 치료제 시장보다 규모가 작지만 2032년에는 76억달러(약 11억1430억원)로 성장할 것으로 전망된다.
HLB 관계자는 “간암 1차 치료제의 경우 파트너사인 항서제약이 중국에서 이미 임상 2상을 끝내 좋은 결과를 얻은 적응증으로, 시장 규모가 매우 크고 당시 소라페닙, 렌바티닙 등 2개의 약물만 허가받아 시장을 양분하고 있었다”라며 “리보세라닙의 약효가 없어서 위암 3차 치료제 임상을 이어가지 않은 것이 아니다”라고 설명했다.
리보세라닙 단독요법보다 캄렐리주맙과 병용 시 더 좋은 약효가 확인된 것도 항서제약과 협업에 힘을 싣는 요인이었다. HLB 관계자는 “캄렐리주맙과 병용 시 더 좋은 약효가 확인됐기 때문에 간암 1차 치료제로 리보세라닙+캄렐리주맙 병용요법을 진행 시 기존 치료제 대비 확실한 우위를 점할 수 있을 것으로 판단했다”며 “제한된 자원에서 성공 확률과 시장성을 높이기 위한 전략적 판단으로 결정한 것”이라고 강조했다.
결과적으로 HLB와 항서제약은 한 배를 탄 처지지만 키는 항서제약이 쥐고 있는 것으로 보인다. 캄렐리주맙이 FDA의 관문을 넘어야 리보세라닙도 병용요법으로 신약허가를 받고 북미 시장에 진출할 수 있기 때문이다. 항서제약이 중국 제약사라는 점이 걸림돌로 작용할 것이라는 우려도 여전하다.
업계 관계자는 “CMC 보완 요구를 해결하더라도 생산시설 실사를 또 나올 수도 있고 이 경우 HLB 생각보다 시간이 더 걸릴 수도 있다”면서 “이것만 해결되면 신약 승인을 받을 수 있을지도 확실치는 않다. FDA가 과학적으로 판단하는 기업이라 해도 생물보안법 등 정치적 영향을 아예 배제하긴 어려울 수도 있다”고 언급했다.