팜이데일리 프리미엄 기사를 무단 전재·유포하는 행위는 불법이며 형사 처벌 대상입니다.
이에 대해 팜이데일리는 무관용 원칙을 적용해 강력히 대응합니다.
이에 대해 팜이데일리는 무관용 원칙을 적용해 강력히 대응합니다.
이 기사는 2024년12월4일 9시4분에 팜이데일리 프리미엄 콘텐츠로 선공개 되었습니다.
구독하기
[이데일리 유진희 기자] 방사선의약품개발업체 셀비온(308430)이 전이성 거세저항성 전립선암의 중간 결과에서 높은 수준의 효과를 확인하며, 상용화에 청신화를 켰다. 셀비온은 내년 3월까지 임상을 마치고, 10월에는 상용화에 나선다는 목표다.
독립적 영상 평가 위원회로부터 결과 수령
3일 셀비온은 최근 전이성 거세저항성 전립선암 환자에서 Ga-68-NGUL/Lu-177-DGUL의 안전성, 내약성, 방사선량 및 항암효과를 평가하기 위한 2상 임상시험 결과를 독립적 영상 평가 위원회로부터 수령했다.
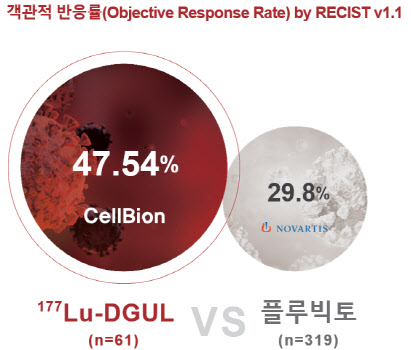
독립적 영상 평가 위원회에 따르면 61명 환자 대상 객관적 반응률(ORR) 47.5%로 2022년 3월 미국 식품의약국(FDA)의 승인을 받은 방사성의약품 전립선암 치료제 ‘플루빅토’를 크게 웃돌았다. 앞선 플루빅토의 임상 3상에서는 319명을 대상으로 한 결과, ORR은 29.8%로 보고됐다. ORR은 전체 환자 중 종양 크기 축소 등 객관적 치료 반응을 확인할 수 있는 환자 수의 비율을 뜻한다.
김권 셀비온 대표는 “앞선 중간 결과보다도 더 좋은 수치가 나와 고무적이다”라며 “최종 73명의 임상 데이터를 확인하게 된다”라고 설명했다.
이어 “플로빅토의 경우 319명을 대상으로 했다는 차이점이 있지만, 국내에서 말기암 환자로 70명 넘게 임상을 진행하는 것도 의미가 크다”며 “이번 성과는 모든 치료 방법이 실패한 전립선암 환자를 위한 새로운 치료제 개발 가능성을 다시 열어준 중요한 진전이다”라고 덧붙였다.
셀비온은 이번 임상 2상 시험에서 총 91명의 환자를 등록했으며, 이 중 73명이 임상시험계획서에 따라 최종 분석대상자군으로 분류됐다. 분석대상자 73명 중 지난달 6일을 기준으로 61명의 환자군에 대해 ORR 평가를 독립적 영상 평가 위원회에서 진행했다.
구체적인 데이터를 살펴보면 61명 중 29명에서 완전 반응(CR) 또는 부분 반응(PR)이 확인돼 ORR은 47.54%로 나타났다. PET/CT 영상이 확보된 59명의 대상자 중 46명에서 완전 대사 반응(CMR) 또는 부분 대사 반응(PMR)이 확인돼 총 대사 반응률이 77.97%에 달했다.
비급여 공급가 2700만원 수준…내년 10월 출시 목표
셀비온은 Lu-177-DGUL이 상용화되면 매출 성장에 크게 기여할 것으로 분석하고 있다. 실적 성장을 확신하는 배경에는 Lu-177-DGUL이 타깃하는 시장에 있다. 플로토빅의 지난해 매출은 9억 8000만 달러(약 1조 4000억원)에 이른다. 셀비온은 내년 1분기까지 임상을 완료하고 10월경에 제품을 출시한다는 계획이다. Lu-177-DGUL의 비급여 공급가는 2700만원 수준으로 책정할 예정이다.
식품의약품안전처는 표준치료법에 실패한 전이성 거세저항성 전립선암 환자의 치료기회와 선택권 확대 등을 위해 앞서 Lu-177-DGUL을 희귀의약품으로 지정했다. 임상 3상까지 가지 않고 임상 2상만 통과해도 조건부로 시판을 허가받을 수 있다는 의미이다.
셀비온은 임상 2상의 유효성과 안전성 데이터에 기반해 복수의 글로벌 제약·바이오사와 본격적인 기술수출을 논의하게 될 것으로 보고 있다. 앞서 출시된 플로빅토가 판매된 지 2년 만에 블록버스터 신약으로 등극한 만큼 조 단위 규모의 기술수출도 가능할 것으로 점쳐진다.
김 대표는 “이번 임상의 마지막 환자 투여는 2025년 3월로 최종 분석 보고서(CSR)를 수령한 뒤 2025년에 허가 신청을 진행할 것”이라며 “Lu-177-DGUL이 본격적으로 판매되는 2026년에 국내에서만 370억원의 매출이 발생할 것으로 보고 있다”고 말했다.
한편 이번 임상의 분석대상자군(FAS)은 임상시험용 의약품을 최소 1회 이상 투여받고, 이후 ORR을 측정한 환자로 구성됐다. 관련 수치는 임상시험의 진행 과정에서 변동될 수 있으며, CSR 작성 시 변경될 가능성이 있다.
|
독립적 영상 평가 위원회로부터 결과 수령
3일 셀비온은 최근 전이성 거세저항성 전립선암 환자에서 Ga-68-NGUL/Lu-177-DGUL의 안전성, 내약성, 방사선량 및 항암효과를 평가하기 위한 2상 임상시험 결과를 독립적 영상 평가 위원회로부터 수령했다.
독립적 영상 평가 위원회에 따르면 61명 환자 대상 객관적 반응률(ORR) 47.5%로 2022년 3월 미국 식품의약국(FDA)의 승인을 받은 방사성의약품 전립선암 치료제 ‘플루빅토’를 크게 웃돌았다. 앞선 플루빅토의 임상 3상에서는 319명을 대상으로 한 결과, ORR은 29.8%로 보고됐다. ORR은 전체 환자 중 종양 크기 축소 등 객관적 치료 반응을 확인할 수 있는 환자 수의 비율을 뜻한다.
김권 셀비온 대표는 “앞선 중간 결과보다도 더 좋은 수치가 나와 고무적이다”라며 “최종 73명의 임상 데이터를 확인하게 된다”라고 설명했다.
이어 “플로빅토의 경우 319명을 대상으로 했다는 차이점이 있지만, 국내에서 말기암 환자로 70명 넘게 임상을 진행하는 것도 의미가 크다”며 “이번 성과는 모든 치료 방법이 실패한 전립선암 환자를 위한 새로운 치료제 개발 가능성을 다시 열어준 중요한 진전이다”라고 덧붙였다.
셀비온은 이번 임상 2상 시험에서 총 91명의 환자를 등록했으며, 이 중 73명이 임상시험계획서에 따라 최종 분석대상자군으로 분류됐다. 분석대상자 73명 중 지난달 6일을 기준으로 61명의 환자군에 대해 ORR 평가를 독립적 영상 평가 위원회에서 진행했다.
구체적인 데이터를 살펴보면 61명 중 29명에서 완전 반응(CR) 또는 부분 반응(PR)이 확인돼 ORR은 47.54%로 나타났다. PET/CT 영상이 확보된 59명의 대상자 중 46명에서 완전 대사 반응(CMR) 또는 부분 대사 반응(PMR)이 확인돼 총 대사 반응률이 77.97%에 달했다.
|
비급여 공급가 2700만원 수준…내년 10월 출시 목표
셀비온은 Lu-177-DGUL이 상용화되면 매출 성장에 크게 기여할 것으로 분석하고 있다. 실적 성장을 확신하는 배경에는 Lu-177-DGUL이 타깃하는 시장에 있다. 플로토빅의 지난해 매출은 9억 8000만 달러(약 1조 4000억원)에 이른다. 셀비온은 내년 1분기까지 임상을 완료하고 10월경에 제품을 출시한다는 계획이다. Lu-177-DGUL의 비급여 공급가는 2700만원 수준으로 책정할 예정이다.
식품의약품안전처는 표준치료법에 실패한 전이성 거세저항성 전립선암 환자의 치료기회와 선택권 확대 등을 위해 앞서 Lu-177-DGUL을 희귀의약품으로 지정했다. 임상 3상까지 가지 않고 임상 2상만 통과해도 조건부로 시판을 허가받을 수 있다는 의미이다.
셀비온은 임상 2상의 유효성과 안전성 데이터에 기반해 복수의 글로벌 제약·바이오사와 본격적인 기술수출을 논의하게 될 것으로 보고 있다. 앞서 출시된 플로빅토가 판매된 지 2년 만에 블록버스터 신약으로 등극한 만큼 조 단위 규모의 기술수출도 가능할 것으로 점쳐진다.
김 대표는 “이번 임상의 마지막 환자 투여는 2025년 3월로 최종 분석 보고서(CSR)를 수령한 뒤 2025년에 허가 신청을 진행할 것”이라며 “Lu-177-DGUL이 본격적으로 판매되는 2026년에 국내에서만 370억원의 매출이 발생할 것으로 보고 있다”고 말했다.
한편 이번 임상의 분석대상자군(FAS)은 임상시험용 의약품을 최소 1회 이상 투여받고, 이후 ORR을 측정한 환자로 구성됐다. 관련 수치는 임상시험의 진행 과정에서 변동될 수 있으며, CSR 작성 시 변경될 가능성이 있다.
유진희 sadend@






!['2% 로열티'가 무너뜨린 신뢰…알테오젠發 바이오株 동반 하락[바이오맥짚기]](https://image.edaily.co.kr/images/vision/files/NP/S/2026/01/PS26012201091b.jpg)
