유한양행 ‘렉라자’, 美 FDA 허가 다음 타자 노린다
등록 2022-09-23 오전 7:50:26
- 유력한 다음타자 한미 ‘포지오티닙’은 FDA 통과 적신호
얀센, 내년 FDA에 패스트트랙으로 렉라자 NDA 신청할 듯
31호 신약 렉라자, 지난해 7월 韓출시…누적매출 110억원
렉라자, 올해 국내 매출 300억원 목표…“목표달성 이상 無”
팜이데일리 프리미엄 기사를 무단 전재·유포하는 행위는 불법이며 형사 처벌 대상입니다.
이에 대해 팜이데일리는 무관용 원칙을 적용해 강력히 대응합니다.
이에 대해 팜이데일리는 무관용 원칙을 적용해 강력히 대응합니다.
이 기사는 2022년9월23일 7시50분에 팜이데일리 프리미엄 콘텐츠로 선공개 되었습니다.
구독하기
[이데일리 나은경 기자] 유한양행(000100)의 ‘렉라자’(성분명 ‘레이저티닙’)가 한미약품의 호중구감소증 치료제 ‘롤론티스’에 이어 미국 식품의약국(FDA)의 문턱을 넘을 두 번째 K-신약으로 주목받고 있다. 레이저티닙이 타깃하는 비소세포폐암은 시장 규모만 수십조에 달하기 때문에 국내 최초로 연 매출 1조원을 넘길 글로벌 블록버스터 신약으로 등극할 가능성도 점쳐진다.
21일 제약·바이오 업계에 따르면 유한양행으로부터 레이저티닙을 기술이전해 간 글로벌 제약사 얀센은 내년 중 미국 FDA 승인에 도전할 것으로 예상된다. 일각에서는 얀센이 연내 FDA 신청에 나설 것이라는 전망도 나왔지만 ‘아미반타맙’과 레이저티닙의 병용 임상 3상 등 주요 임상들의 예상 종료 시점이 내년 상반기인 것을 감안하면 FDA 신청 시기도 내년이 유력할 것이라는 해석이다.
현재 얀센과 유한양행이 진행 중인 레이저티닙 관련 임상 중 가장 결과가 주목되는 임상은 1000명의 폐암 환자를 대상으로 동일계열 경쟁약물인 아스트라제네카의 ‘타그리소’(성분명 ‘오시머티닙’)와 레이저티닙의 약효를 직접비교하는 마리포사(MARIPOSA) 임상이다. 여기서 타그리소 대비 레이저티닙의 경쟁력이 확인되면 향후 미국 혁신신약신청(BTD)도 가능할 것이라는 기대감이 나온다.
업계에서는 얀센이 레이저티닙을 FDA의 신속승인제도(패스트트랙)로 품목허가 신청에 나설 것으로 본다. 패스트트랙으로 지정되면 개발 단계마다 FDA 지원을 받을 수 있고 일반적인 절차를 밟을 때보다 신속한 품목허가가 가능해진다.
얀센은 최근 클리니컬 트라이얼에 레이저티닙과 미다졸람, 메트포르민 등 타 약물간 상호작용을 평가하는 글로벌 임상 1상의 시험계획을 등재했는데 이 역시 FDA 신청시기가 머지않았다는 신호로 해석된다. FDA는 환자가 기존에 처방받아온 약물과 신약을 함께 복용했을 때 나타날 부작용을 최소화하기 위해 신약허가신청 서류 접수시 약물 상호작용 평가 임상자료를 요구하는 것으로 알려져 있다.
‘처방의약품 신청자 수수료법’(PDUFA)에 따라 신약허가신청서(NDA)를 제출하면 FDA의 심사개시 결정일로부터 일반심사는 10개월, 우선심사는 6개월 내 최종 허가 여부를 결정해야 한다. 이 때문에 이르면 내년 중 레이저티닙 품목허가 여부가 판가름 날 수 있다.
비소세포폐암은 미충족 의료수요가 큰 분야다. 글로벌 의약품시장 조사업체 포천비즈니스인사이트는 비소세포폐암 치료제 시장 규모가 2018년 약 19조7000억원(160억 달러)에서 해마다 13.4%씩 성장해 2026년 약 437억달러(53조8000억원)에 이를 것으로 전망한다.
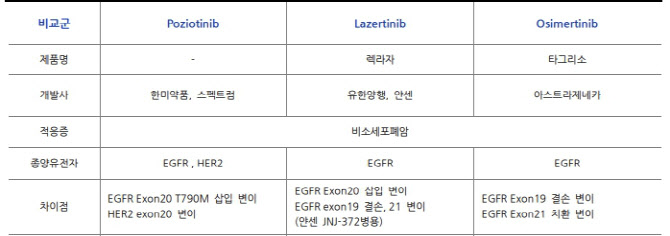
한미약품(128940)의 포지오티닙 역시 FDA의 패스트트랙으로 신약허가 절차를 밟고 있다. 포지오티닙과 레이저티닙 모두 비소세포폐암 변이를 타깃으로 하며 타그리소와 동일 계열 경쟁약물이지만 세부적으로 포지오티닙은 HER2, EXON20 삽입변이를, 레이저티닙은 표피성장인자수용체(EGFR) T790M 변이를 타깃으로 한다는 차이점이 있다. 포지오티닙이 타깃하는 HER2 변이의 경우 지난달 엔허투가 폐암까지 적응증을 넓혀 FDA 승인을 받기 전까지 치료제가 없었기 때문에 특히 주목받았다.
오는 11월24일 시판허가 여부가 결정되는 포지오티닙은 롤론티스에 이어 FDA를 통과할 가장 유력한 2번타자로 여겨졌다. 하지만 최근 FDA가 종양약물자문위원회(ODAC) 회의에 앞서 공개한 브리핑 문서를 통해 객관적 반응률이 28%로 낮고 안전성 측면에서도 약물 내성이 낮다는 우려를 제기하면서 FDA 승인 가능성에 적신호가 켜졌다.
레이저티닙은 유한양행이 2015년 국내 신약개발 바이오벤처 오스코텍으로부터 도입한 신약후보물질이다. 유한양행을 거쳐 2018년 미국 얀센에 12억5500만달러(약 1조7500억원) 규모로 기술이전됐다. 이후 지난해 7월 렉라자의 급여목록 등재와 함께 국내 출시됐는데 출시 1년만에 청구액 기준 누적매출만 110억원에 달할 정도로 매출 성장세가 빠르다.
아이큐비아에 따르면 올 상반기 누적 매출액은 69억원이다. 다만 이는 보험청구금액을 기준으로 한 것이기 때문에 실제 유한양행이 집계 중인 매출액은 이보다 높은 것으로 알려졌다. 유한양행은 앞서 올해 렉라자의 국내 매출 목표를 300억원으로 잡았다. 현재까지 누적 매출로 봤을 때 올해 매출 목표 달성은 무난할 것으로 보인다는 게 회사측 설명이다.
|
21일 제약·바이오 업계에 따르면 유한양행으로부터 레이저티닙을 기술이전해 간 글로벌 제약사 얀센은 내년 중 미국 FDA 승인에 도전할 것으로 예상된다. 일각에서는 얀센이 연내 FDA 신청에 나설 것이라는 전망도 나왔지만 ‘아미반타맙’과 레이저티닙의 병용 임상 3상 등 주요 임상들의 예상 종료 시점이 내년 상반기인 것을 감안하면 FDA 신청 시기도 내년이 유력할 것이라는 해석이다.
현재 얀센과 유한양행이 진행 중인 레이저티닙 관련 임상 중 가장 결과가 주목되는 임상은 1000명의 폐암 환자를 대상으로 동일계열 경쟁약물인 아스트라제네카의 ‘타그리소’(성분명 ‘오시머티닙’)와 레이저티닙의 약효를 직접비교하는 마리포사(MARIPOSA) 임상이다. 여기서 타그리소 대비 레이저티닙의 경쟁력이 확인되면 향후 미국 혁신신약신청(BTD)도 가능할 것이라는 기대감이 나온다.
업계에서는 얀센이 레이저티닙을 FDA의 신속승인제도(패스트트랙)로 품목허가 신청에 나설 것으로 본다. 패스트트랙으로 지정되면 개발 단계마다 FDA 지원을 받을 수 있고 일반적인 절차를 밟을 때보다 신속한 품목허가가 가능해진다.
얀센은 최근 클리니컬 트라이얼에 레이저티닙과 미다졸람, 메트포르민 등 타 약물간 상호작용을 평가하는 글로벌 임상 1상의 시험계획을 등재했는데 이 역시 FDA 신청시기가 머지않았다는 신호로 해석된다. FDA는 환자가 기존에 처방받아온 약물과 신약을 함께 복용했을 때 나타날 부작용을 최소화하기 위해 신약허가신청 서류 접수시 약물 상호작용 평가 임상자료를 요구하는 것으로 알려져 있다.
‘처방의약품 신청자 수수료법’(PDUFA)에 따라 신약허가신청서(NDA)를 제출하면 FDA의 심사개시 결정일로부터 일반심사는 10개월, 우선심사는 6개월 내 최종 허가 여부를 결정해야 한다. 이 때문에 이르면 내년 중 레이저티닙 품목허가 여부가 판가름 날 수 있다.
비소세포폐암은 미충족 의료수요가 큰 분야다. 글로벌 의약품시장 조사업체 포천비즈니스인사이트는 비소세포폐암 치료제 시장 규모가 2018년 약 19조7000억원(160억 달러)에서 해마다 13.4%씩 성장해 2026년 약 437억달러(53조8000억원)에 이를 것으로 전망한다.
|
한미약품(128940)의 포지오티닙 역시 FDA의 패스트트랙으로 신약허가 절차를 밟고 있다. 포지오티닙과 레이저티닙 모두 비소세포폐암 변이를 타깃으로 하며 타그리소와 동일 계열 경쟁약물이지만 세부적으로 포지오티닙은 HER2, EXON20 삽입변이를, 레이저티닙은 표피성장인자수용체(EGFR) T790M 변이를 타깃으로 한다는 차이점이 있다. 포지오티닙이 타깃하는 HER2 변이의 경우 지난달 엔허투가 폐암까지 적응증을 넓혀 FDA 승인을 받기 전까지 치료제가 없었기 때문에 특히 주목받았다.
오는 11월24일 시판허가 여부가 결정되는 포지오티닙은 롤론티스에 이어 FDA를 통과할 가장 유력한 2번타자로 여겨졌다. 하지만 최근 FDA가 종양약물자문위원회(ODAC) 회의에 앞서 공개한 브리핑 문서를 통해 객관적 반응률이 28%로 낮고 안전성 측면에서도 약물 내성이 낮다는 우려를 제기하면서 FDA 승인 가능성에 적신호가 켜졌다.
레이저티닙은 유한양행이 2015년 국내 신약개발 바이오벤처 오스코텍으로부터 도입한 신약후보물질이다. 유한양행을 거쳐 2018년 미국 얀센에 12억5500만달러(약 1조7500억원) 규모로 기술이전됐다. 이후 지난해 7월 렉라자의 급여목록 등재와 함께 국내 출시됐는데 출시 1년만에 청구액 기준 누적매출만 110억원에 달할 정도로 매출 성장세가 빠르다.
아이큐비아에 따르면 올 상반기 누적 매출액은 69억원이다. 다만 이는 보험청구금액을 기준으로 한 것이기 때문에 실제 유한양행이 집계 중인 매출액은 이보다 높은 것으로 알려졌다. 유한양행은 앞서 올해 렉라자의 국내 매출 목표를 300억원으로 잡았다. 현재까지 누적 매출로 봤을 때 올해 매출 목표 달성은 무난할 것으로 보인다는 게 회사측 설명이다.
나은경 eeee@





![[르포] 안드로이드 탄생한 보스턴CIC가보니…"K-바이오, 빅딜 마중물"](https://image.edaily.co.kr/images/vision/files/NP/S/2025/07/PS25071401146b.jpg)
![유한양행 ‘렉라자’ 글로벌 매출 급증에 20% ↑…제넥신·국전약품 上[바이오 맥짚기]](https://image.edaily.co.kr/images/vision/files/NP/S/2025/07/PS25071800211b.jpg)
![美FDA, 신약 허가 거절시 보완요구서한 공개[제약·바이오 해외토픽]](https://image.edaily.co.kr/images/vision/files/NP/S/2025/07/PS25071900105b.jpg)