샤페론 ‘누겔’, FDA 임상승인 지연…기술수출은 언제?
등록 2023-09-07 오전 9:04:09
- FDA의 일반적인 임상 승인 기준일 30일 넘도록 임상 '미승인'
"FDA 내부 사정으로 임상 허가 지연…2026년 이후 미국 L/O"
이 기사는 2023년9월7일 9시4분에 팜이데일리 프리미엄 콘텐츠로 선공개 되었습니다.
구독하기
[이데일리 김진수 기자] 샤페론(378800)이 준비한 아토피 치료 후보물질 ‘누겔’ 효능 검증 임상에 대한 미국 식품의약국(FDA) 승인이 예상보다 늦어졌지만 샤페론은 임상이나 후보물질 자체에 문제가 있는 것이 아니라는 입장이다.
샤페론은 미국에서 임상 2상까지 진행한 뒤 해당 데이터를 기반으로 기술수출한다는 계획으로, 임상이 종료되는 2026년 상반기 이후에야 미국 시장에 기술수출이 가능할 전망이다.
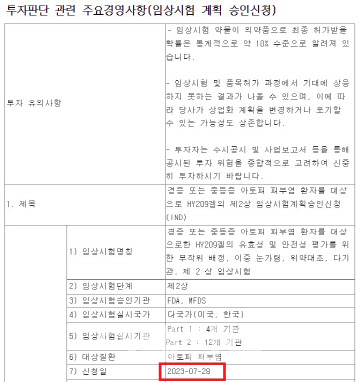
5일 샤페론에 따르면 지난달 말 샤페론은 FDA에 아토피 치료 후보물질 ‘누겔’ 임상 2상 시험계획서를 제출했지만, FDA의 일반적 심사 기간인 30일이 지나도록 임상에 대한 승인 통보를 받지 못한 채 승인 결정을 기다리다 이달 7일 오후 늦게 임상을 승인 받았다.
누겔은 아토피 피부염 증상을 악화시키는 체내 면역 단백질 ‘사이토카인’의 발현을 낮추고 염증 조절 세포 수를 늘리는 기전의 치료 후보물질이다. 샤페론은 이번 임상을 통해 경증 또는 중등증 아토피 피부염 환자 210명에게 누겔을 투여해 습진 범위와 중증도 지수를 얼마나 개선하는지를 위약군 비교 방식으로 효과를 확인할 예정이다.
샤페론의 계획과 달리 누겔의 FDA 임상 승인이 늦오지면서 이후 계획들도 조금씩 미뤄질 것으로 예상된다.
FDA는 임상 신청이 접수되면 접수날부터 30일 내 신청된 자료를 검토한다. 30일 동안 별다른 수정이나 보완 통지가 없고 FDA 측에서 임상과 관련해 문제를 제기하지 않는 경우, 임상은 자동 승인된 것으로 간주되며 임상을 신청한 주체는 연구를 시작할 수 있다.
샤페론이 FDA에 아토피 치료 후보물질 ‘누겔’의 임상 2상을 신청한 시점은 7월 28일이다. FDA의 심사가 정상적으로 진행됐다면 8월 말에는 임상 시험 승인 여부가 결정됐어야 한다. 하지만 한 달이 넘도록 FDA에서 승인과 관련한 통보가 없었고 샤페론은 FDA에 임상 승인을 신청한 지 약 40일 뒤인 7일 늦은 오후 임상을 승인 받았다고 공시했다.
“CRO 통해 FDA 내부 문제로 임상 허가 지연된다는 소식 들어”
샤페론 관계자는 이번 미국 임상에 대한 FDA 허가가 미뤄지는 이유와 관련해 “FDA 내부 사정이라는 답변을 받았으며 구체적인 이유에 대해서는 정확히 듣지 못했다”고 설명했다.
미국에서 임상을 담당하는 임상시험 수탁기관(CRO)으로부터 연락이 왔는데, FDA가 CRO에 ‘내부 사정에 따라 임상 승인에 대한 검토가 지연되고 있다’라는 내용의 레터를 보냈고 이를 전달 받았다는 것이다.
사페론 관계자는 “이번 임상 허가가 늦어지는 이유는 임상 디자인 등의 문제가 아니며 FDA 내부적인 문제”라고 밝혔다.
다만, 업계에서는 이번 FDA의 임상 허가 연기를 두고 “임상 신청 후 FDA 내부 사정으로 임상이 연기되는 것은 흔한 일은 아니다”라고 입을 모았다.
한 바이오 기업에서 임상 관련 업무를 담당하는 관계자는 “일반적으로 임상을 신청하는 경우 임상 허가까지 규제기관과 긴밀하게 소통하면서 의견을 주고 받는다”라며 “FDA에서 내부적인 사정으로 임상 지연을 알렸다면 임상 신청 기업이나 CRO에서 어떤 사유인지 등을 물어보는 것이 상식적”이라고 언급했다.
또 다른 바이오 기업 관계자는 “임상 승인이 30일 내 이뤄지지 않고 미뤄질 때는 FDA에서 임상과 관련해 의견을 전달한 경우가 많다”며 “FDA 내부 사정으로 인해 임상 승인에 대한 검토가 늦어졌다는 이야기는 들어본 적 없다”고 말했다.
실제로 비슷한 시기 FDA에 임상 시험계획서를 제출했던 또 다른 바이오 기업은 FDA에서 규정하고 있는 30일에 맞춰 임상을 승인받았다.
美 임상 2상 승인 밀리면서 기술수출 시점도 밀려
샤페론은 미국 시장에서 임상 2상 완료 후 기술수출한다는 계획으로, 임상 승인이 미뤄진 만큼 기술수출 시점도 미뤄지게 됐다.
계획대로라면 샤페론은 지난달 누겔의 미국 임상 2상을 승인받은 뒤 2026년 1분기에 임상을 종료하고 기술수출에 나설 예정이다.
샤페론 관계자는 “아직까지 미국 시장에 대한 기술수출 논의는 이뤄지는 것이 없으며 임상 2상까지 진행한 후 데이터를 통해 기술수출에 나설 계획은 변함 없다”고 말했다.
다만, 현재 중국의 제약사가 누겔에 대해 관심을 보이고 있어 중국 지역 권리에 대한 기술수출은 미국 임상 승인 및 별개로 이뤄질 가능성도 있다. 샤페론 관계자는 “미국 임상 및 기술수출과 별개로 중국 시장 기술수출도 준비하는 중”이라고 밝혔다.
샤페론은 미국에서 임상 2상까지 진행한 뒤 해당 데이터를 기반으로 기술수출한다는 계획으로, 임상이 종료되는 2026년 상반기 이후에야 미국 시장에 기술수출이 가능할 전망이다.
5일 샤페론에 따르면 지난달 말 샤페론은 FDA에 아토피 치료 후보물질 ‘누겔’ 임상 2상 시험계획서를 제출했지만, FDA의 일반적 심사 기간인 30일이 지나도록 임상에 대한 승인 통보를 받지 못한 채 승인 결정을 기다리다 이달 7일 오후 늦게 임상을 승인 받았다.
누겔은 아토피 피부염 증상을 악화시키는 체내 면역 단백질 ‘사이토카인’의 발현을 낮추고 염증 조절 세포 수를 늘리는 기전의 치료 후보물질이다. 샤페론은 이번 임상을 통해 경증 또는 중등증 아토피 피부염 환자 210명에게 누겔을 투여해 습진 범위와 중증도 지수를 얼마나 개선하는지를 위약군 비교 방식으로 효과를 확인할 예정이다.
|
FDA는 임상 신청이 접수되면 접수날부터 30일 내 신청된 자료를 검토한다. 30일 동안 별다른 수정이나 보완 통지가 없고 FDA 측에서 임상과 관련해 문제를 제기하지 않는 경우, 임상은 자동 승인된 것으로 간주되며 임상을 신청한 주체는 연구를 시작할 수 있다.
샤페론이 FDA에 아토피 치료 후보물질 ‘누겔’의 임상 2상을 신청한 시점은 7월 28일이다. FDA의 심사가 정상적으로 진행됐다면 8월 말에는 임상 시험 승인 여부가 결정됐어야 한다. 하지만 한 달이 넘도록 FDA에서 승인과 관련한 통보가 없었고 샤페론은 FDA에 임상 승인을 신청한 지 약 40일 뒤인 7일 늦은 오후 임상을 승인 받았다고 공시했다.
“CRO 통해 FDA 내부 문제로 임상 허가 지연된다는 소식 들어”
샤페론 관계자는 이번 미국 임상에 대한 FDA 허가가 미뤄지는 이유와 관련해 “FDA 내부 사정이라는 답변을 받았으며 구체적인 이유에 대해서는 정확히 듣지 못했다”고 설명했다.
미국에서 임상을 담당하는 임상시험 수탁기관(CRO)으로부터 연락이 왔는데, FDA가 CRO에 ‘내부 사정에 따라 임상 승인에 대한 검토가 지연되고 있다’라는 내용의 레터를 보냈고 이를 전달 받았다는 것이다.
사페론 관계자는 “이번 임상 허가가 늦어지는 이유는 임상 디자인 등의 문제가 아니며 FDA 내부적인 문제”라고 밝혔다.
다만, 업계에서는 이번 FDA의 임상 허가 연기를 두고 “임상 신청 후 FDA 내부 사정으로 임상이 연기되는 것은 흔한 일은 아니다”라고 입을 모았다.
한 바이오 기업에서 임상 관련 업무를 담당하는 관계자는 “일반적으로 임상을 신청하는 경우 임상 허가까지 규제기관과 긴밀하게 소통하면서 의견을 주고 받는다”라며 “FDA에서 내부적인 사정으로 임상 지연을 알렸다면 임상 신청 기업이나 CRO에서 어떤 사유인지 등을 물어보는 것이 상식적”이라고 언급했다.
또 다른 바이오 기업 관계자는 “임상 승인이 30일 내 이뤄지지 않고 미뤄질 때는 FDA에서 임상과 관련해 의견을 전달한 경우가 많다”며 “FDA 내부 사정으로 인해 임상 승인에 대한 검토가 늦어졌다는 이야기는 들어본 적 없다”고 말했다.
실제로 비슷한 시기 FDA에 임상 시험계획서를 제출했던 또 다른 바이오 기업은 FDA에서 규정하고 있는 30일에 맞춰 임상을 승인받았다.
美 임상 2상 승인 밀리면서 기술수출 시점도 밀려
샤페론은 미국 시장에서 임상 2상 완료 후 기술수출한다는 계획으로, 임상 승인이 미뤄진 만큼 기술수출 시점도 미뤄지게 됐다.
계획대로라면 샤페론은 지난달 누겔의 미국 임상 2상을 승인받은 뒤 2026년 1분기에 임상을 종료하고 기술수출에 나설 예정이다.
샤페론 관계자는 “아직까지 미국 시장에 대한 기술수출 논의는 이뤄지는 것이 없으며 임상 2상까지 진행한 후 데이터를 통해 기술수출에 나설 계획은 변함 없다”고 말했다.
다만, 현재 중국의 제약사가 누겔에 대해 관심을 보이고 있어 중국 지역 권리에 대한 기술수출은 미국 임상 승인 및 별개로 이뤄질 가능성도 있다. 샤페론 관계자는 “미국 임상 및 기술수출과 별개로 중국 시장 기술수출도 준비하는 중”이라고 밝혔다.
김진수 기자 kim89@




![[단독]바이오니아, 코스메르나 국내출시 임박...제2의 '비에날씬' 힘들듯](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/03/PS24032600120b.jpg)
![[참 고소한 이야기]치매 예방에 탁월한 들기름](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/04/PS24042000024b.jpg)
![[아미코젠 대해부①] 바이오 원료 국산화 선봉장 신용철 아미코젠 의장](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/03/PS24032000190b.jpg)
![모더나, 신약 개발 업무에 챗GPT 활용[제약·바이오 해외토픽]](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/04/PS24042700037b.jpg)